Trombose
O que é uma trombose? E uma embolia?
Trombose é um termo que designa a formação de um trombo em algum vaso sanguíneo (veias ou artérias) em nosso organismo. Trombo é uma estrutura composta por glóbulos brancos, vermelhos e plaquetas e uma proteína que as liga (como uma cola), chamada fibrina. Um termo popularmente utilizado para descrever trombos é coágulo.
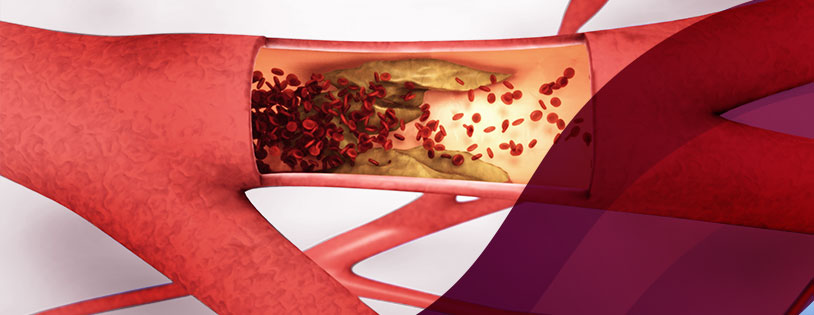
Os trombos existem e se formam em nosso organismo para auxiliar no controle de sangramentos. Todas as vezes que nos cortamos ou nos ferimos de uma maneira que produza um sangramento é a formação de pequenos trombos que auxilia na contenção desse sangramento. Nosso organismo regula muito bem a formação de trombos, dispondo de sistemas específicos para destruí-los, com o objetivo de impedir que estes se formem e cresçam descontroladamente. A trombose ocorre justamente quando um destes coágulos se forma num vaso sanguíneo, adquire grandes proporções e interrompe parcial ou totalmente a circulação do sangue, causando consequências que vão desde um inchaço e dor em uma ou ambas as pernas, até consequências fatais, geralmente relacionadas às embolias de pulmão. Um êmbolo é um pequeno pedaço de um trombo que se desprende, sendo levado pelo sangue até alcançar um vaso sanguíneo cujo diâmetro é menor que o diâmetro do êmbolo. Isso provoca uma interrupção da circulação do sangue nesse vaso, impedindo que o sangue alcance seu destino. Esse contínuo entre trombose e embolia é que gera o termo tromboembolismo.
O tromboembolismo pulmonar (popularmente conhecido como embolia de pulmão), por exemplo, ocorre quando o vaso obstruído pelo êmbolo é um dos que levam sangue do coração para o pulmão, interrompendo total ou parcialmente o transporte de sangue entre os dois órgãos, o que pode, a depender da gravidade, ser fatal.
É por essa razão (possibilidade de embolia) que o tratamento inicial da trombose se baseia no uso de anticoagulantes. Esses medicamentos reduzem muito o risco de formação de novos coágulos e de êmbolos a partir do coágulo já existente, por isso são eficazes em prevenir complicações fatais de uma trombose. Discutiremos os tipos de anticoagulantes e o tempo que é necessário usá-los mais adiante. Diferentemente do que muitos acreditam, porém, os anticoagulantes não têm como objetivo “desfazer” os coágulos. Os medicamentos que exercem esse efeito são denominados trombolíticos e apesar da sua ação eficaz em destruir os trombos apresentam risco de sangramento muito elevado, sendo reservados somente para situações de tromboses muito extensas.
E por que as tromboses acontecem?
Essa, provavelmente, é a questão que mais aflige quem teve trombose e a que mais leva essas pessoas a procurarem um hematologista. Os fatores fundamentais envolvidos na ocorrência de uma trombose foram inicialmente propostos pelo patologista alemão Rudolf Virchow, no século XIX, no que ficou conhecido como “tríade de Virchow”. Os elementos dessa tríade são: hipercoagulabilidade do sangue; estase (fluxo sanguíneo lentificado) do sangue nos vasos e lesão (inflamação dos vaso sanguíneos). A presença de um ou mais elementos dessa tríade determina a ocorrência das tromboses.
A análise dos elementos dessa tríade nos oferece algumas explicações importantes para determinadas características das tromboses, como por exemplo:
- A preferência das tromboses pelas veias (em relação às artérias) e pelos membros inferiores em relação a outras partes do corpo se dá pelo importante papel da estase sanguínea na origem das tromboses: as veias apresentam fluxo sanguíneo muito mais lento do que as artérias, situação particularmente mais intensa nos membros inferiores, onde o fluxo sanguíneo tem o sentido contrário ao da gravidade, exigindo mais trabalho do sistema circulatório ao impulsioná-lo. Fica claro, portanto, que as veias das pernas são as que tem maior propensão à formação de trombos.
- Ainda, com relação ao papel da estase sanguínea e da comparação entre veias e artérias, o fluxo sanguíneo muito acelerado nessas últimas faz com que muito raramente ocorra a formação de trombos em artérias saudáveis. Os trombos arteriais decorrem geralmente da presença de alguma “doença” em sua parede, como a aterosclerose ou as vasculites (doenças auto-imunes que provocam inflamação nas artérias), ou decorrem da migração de êmbolos de trombos formados em outros locais, como por exemplo no caso do cérebro, em que êmbolos formados a partir de placas de aterosclerose das artérias do pescoço ou de trombos no coração migram até as artérias do cérebro provocando o acidente vascular cerebral, popularmente conhecido como derrame.
Nessa primeira análise fica evidente que a presença de determinadas doenças ou condições que afetam a saúde de um indivíduo podem exercer papel fundamental na ocorrência de uma trombose, como por exemplo o período de recuperação de muitas cirurgias, onde a pessoa frequentemente permanece em repouso e com pouca mobilidade. Essa observação levou à divisão das tromboses venosas em dois grupos: as provocadas e as não provocadas.
As tromboses provocadas são aquelas relacionadas a situações de saúde que uma pessoa enfrenta que, seja pelo aumento da hipercoagulabilidade do sangue, de sua estase nos vasos ou da inflamação destes, aumentam muito o risco de trombose. Esses fatores de risco podem ser fortes ou fracos, transitórios ou persistentes. O câncer, por exemplo, gera um aumento significativo e prolongado (enquanto persistir a doença) da hipercoagulabilidade do sangue. Por outro lado, pacientes submetidos a cirurgias com anestesia geral com duração de mais de 30 minutos, ou internados em um hospital há mais de 3 dias ou ainda mulheres submetidas a uma cesariana, tem um risco elevado numa magnitude parecida aos portadores de câncer, mas de uma maneira mais transitória. Pessoas com trombose associada a estas condições geralmente apresentam um risco muito baixo de recorrência após o término do tratamento com o anticoagulante e por isso costumam usar esse medicamento por períodos fixos de tempo (seis meses ou um ano, por exemplo). A presença desses fatores provocadores e o baixo risco de recorrência associados a tromboses que ocorrem na presença deles, tornam desnecessária, nessas pessoas, a realização de investigações mais amplas sobre a causa da trombose.
Já as tromboses não provocadas são aquelas em que não há a presença de nenhum fator de risco, transitório ou persistente, que interfira nos elementos da tríade de Virchow e justifique sua ocorrência, ou seja, não ocorrem no contexto de cirurgias, imobilidade ou câncer, mas numa pessoa sem qualquer situação que possa explicar sua origem. Pela ausência de fatores que possam explicá-la, esse tipo de trombose costuma exigir uma investigação mais detalhada, com a intenção de excluir algumas doenças que podem estar envolvidas em sua origem, como um câncer não diagnosticado ou a síndrome do anticorpo antifosfolípide. Outra observação importante em relação a esse tipo de trombose é que, uma vez que ela não é provocada por um fator de risco transitório, a tendência de que ela volte a ocorrer após o término do uso da medicação anticoagulante é maior, o que leva, muitas vezes, à necessidade de estender o tempo de uso da medicação anticoagulante por períodos maiores (mais de 1 ano).
Mas e as trombofilias?
As trombofilias (do grego: thrombos, “coágulos” e phillos, “amor, afinidade”) são doenças, na sua grande maioria hereditárias, que causam uma hipercoagulabilidade do sangue, provocando um risco maior de trombose. Descobertas a partir dos anos 1990 e hereditárias em sua maioria (isto é, transmitidas geneticamente dos pais para os filhos), essas doenças rapidamente se tornaram uma das explicações mais comuns para trombose em pessoas sem fatores de risco.
De fato, as trombofilias mais consolidadas, como pode-se observar na tabela abaixo, apresentam um aumento de risco de 2-5, ou até 10 vezes no risco de ocorrência de um primeiro episódio na vida do indivíduo. Isso é muita coisa e pode parecer bem assustador!
Se analisarmos os outros dados da tabela, porém, vamos ver que esses números, que inicialmente causam pavor, não contam toda a história. Menos de 2% (menos de 1% para algumas trombofilias!) dos pacientes portadores de trombofilias hereditárias vão apresentar trombose. Isso é muito pouco! Imagine que, se testássemos toda a população para a mutação fator V de Leiden, encontraríamos 3-7% das pessoas com essa mutação, mas menos de 2% destas desenvolveriam trombose. O que devemos fazer com os 98% restantes? Tratar com anticoagulantes? Percebe-se que esta não seria uma boa conduta, por isso é fundamental saber exatamente em quem pesquisar esse tipo de doença.
Indivíduos com tromboses decorrentes de trombofilias hereditárias costumam apresentar trombose com < 50 anos, não provocada (sem os fatores de risco descritos acima), tem história familiar (parentes próximos com trombose quando jovens) e múltiplos episódios de trombose venosa que acometem locais pouco habituais, como os braços, veias do cérebro ou do abdome. A identificação de uma mutação associada à trombofilia numa pessoa que tenha tido uma trombose fora desse contexto não indica, necessariamente, que uma coisa ocorreu como consequência da outra. E por que isso importa? Importa porque, olhando para a tabela, podemos ver que embora as trombofilias aumentem muito o risco de um primeiro episódio de trombose, elas causam um aumento muito pequeno no risco da ocorrência de um segundo episódio, algo na ordem de 1.5-2 vezes. Você que está lendo isso deve estar achando 1.5-2 vezes muito, mas pense que os fatores de risco para trombose provocada descritos acima (imobilização pós cirurgia, câncer, gestação) aumentam em mais de 10x o risco de uma pessoa ter um episódio de trombose! Ou seja: o achado isolado, sem história famíliar, sem episódios de trombose de repetição, em uma localização habitual como os membros inferiores, de uma mutação relacionada à trombofilia contribui muito pouco para o risco de um segundo episódio de trombose e, portanto, para a decisão de manter o uso de medicamentos anticoagulantes para essa pessoa.
| Deficiência de antitrombina III | Deficiência de proteína C | Deficiência de proteína S | Fator V Leiden | Mutação do gene da protrombina | |
|---|---|---|---|---|---|
| Prevalência na população; | 0.02% | 0.2% | 0.03%-0.13% | 3%-7% | 0.7%-4% |
| Prevalência em pacientes com trombose venosa | 1% | 3% | 2% | 20% | 5% |
| Aumento do risco para o primeiro episódio de trombose | 5-10x | 4-6.5x | 1-10x | 3-5x | 2-3x |
| Aumento do risco para um novo episódio de trombose (em quem já teve um) | 1.9-2.6 | 1.4-1.8 | 1.0-1.4 | 1.4 | 1.4 |
| % dos portadores que desenvolvem uma trombose venosa | 1.5 | 1.5 | 1.5 | 0.5 a 1.8 | 0.4 |
E a síndrome do anticorpo antifosfolípide?
A síndrome do anticorpo antifosfolípide (SAAF) é uma doença adquirida, em que o nosso sistema imunológico produz anticorpos (proteínas produzidas pelas células de defesa do nosso organismo com objetivo de nos defender de micro-organismos, como os vírus e bactérias) que tem como alvo estruturas do próprio organismo. Esses anticorpos, se ligando a algumas proteínas, ativam a coagulação do nosso sangue, provocando grande predisposição à trombose e, em gestantes, eventos obstétricos adversos (óbito fetal, prematuridade, pré-eclâmpsia e mais raramente abortos no início da gestação).
Desta maneira, o diagnóstico da SAAF é firmado quando uma pessoa com antecedente de trombose ou de alguma complicação da gestação tem positividade para um dos três anticorpos antifosfolípides (anticoagulante lúpico, anticardiolipina ou β2-glicoproteína). O tratamento da SAAF é feito com o uso de anticoagulantes; se o diagnóstico de SAAF se deu pela ocorrência de uma trombose, a recomendação é de uso de anticoagulante por período de tempo indeterminado, exceto quando a trombose ocorreu no contexto de fatores de risco fortes, como descrito anteriormente (cirurgias, por exemplo). Já se o diagnóstico se deu por algum evento obstétrico, a recomendação é de uso de ácido acetilsalicílico e anticoagulantes durante toda a gestação até 6 semanas após o parto.
Uma situação muito frequente, porém, principalmente com o aumento da disponibilidade dos testes para detecção dos anticorpos antifosfolípides é a pessoa que nunca teve um evento obstétrico nem uma trombose e apresenta positividade para um ou todos os anticorpos antifosfolípides. Nesse contexto, é preciso esclarecer algumas questões:
- A prevalência de algum dos anticorpos antifosfolípides na população chega a até 10% (quando foram testadas pessoas que foram doar sangue), mas menos de 1% dos indivíduos mantém os anticorpos positivos numa segunda testagem. Por essa razão, é fundamental realizar uma nova pesquisa desses anticorpos após 12 semanas caso haja um primeiro resultado negativo;
- A presença desses anticorpos em pessoas sem antecedente de trombose está associado a um aumento de pequeno a moderado no risco desta pessoa desenvolver um episódio de trombose: numa pessoa sem anticorpos antifosfolipides esse risco é em torno de 0.4%/ano, numa pessoa com o anticoagulante lúpico esse risco vai para 1.3%/ano e naquelas pessoas com positividade para os três anticorpos (anticoagulante lúpico, anticardiolipina e anti- β2 glicoproteína I) esse risco chega a 5.3%/ano. A maioria das pessoas que desenvolvem trombose nessa situação, porém, apresentam algum fator de risco, como diabetes, hipertensão arterial, tabagismo entre outros. Por isso não há, a princípio, indicação de algum anticoagulante preventivo, sendo a principal recomendação mudanças de estilo de vida que controlem os fatores de risco citados acima.
- De maneira semelhante à população geral, nas gestantes a prevalência de anticorpos antifosfolípides é de cerca de 5-6%, não havendo dados conclusivos sobre um maior risco de eventos obstétricos (restrição crescimento intra-uterino, pré-eclâmpsia, óbito fetal, entre outros) nas gestantes sem critério clínico (antecedente de evento obstétrico) para o diagnóstico de SAAF. Assim, não há recomendação para o uso de anticoagulantes ou ácido acetilsalicílico em gestantes com anticorpos antifosfolípides sem qualquer sintoma relacionado.
Mas você não falou das mutações da MTHFR e do PAI!
A MTHFR (metilenotetraidrofolato redutase) é uma enzima envolvida no metabolismo do ácido fólico. As mutações nessa proteína (A1298C e C677T) alteram sua estrutura de maneira que ela se torna menos estável e consequentemente pode ter diminuição da sua atividade.
Por muitos anos, alguns trabalhos mostraram a possibilidade do aumento de risco de trombose venosa ou perda gestacional, principalmente associados à variante C677T, em homozigose (quando uma pessoa recebe uma cópia do gene mutado do pai e uma da mãe, ao invés de receber somente de um dos pais, o que chamamos de heterozigose). Trabalhos mais recentes, porém, descartaram esse impacto a ponto de a Associação Americana de Genética Médica recomendar que “a genotipagem do polimorfismo da MTHFR não deve ser solicitado como parte da avaliação clínica para trombofilia hereditária ou perdas gestacionais recorrentes”.
O PAI-1, por sua vez, é uma proteína cuja função é diminuir a ativação do sistema responsável pela degradação dos trombos (a sigla PAI-1 significa inibidor do ativador do plasminogênio, sendo plasminogênio a proteína que dá origem à plasmina, uma proteína que degrada a fibrina, proteína fundamental na estrutura do trombo). Algumas alterações genéticas levam ao aumento da atividade do PAI-1, o que produz uma maior inibição da ativação do sistema responsável pela degradação de trombos, favorecendo sua formação.
Apesar das consequências na atividade da PAI-1, a relação entre a presença de mutações nessa proteína e a ocorrência de trombose são incertas e a magnitude de aumento do risco de trombose venosa, se existe, é muito pequena. A relação de mutações nesse gene com abortos (talvez a principal situação onde esse exame é solicitado), é ainda mais incerta. De 18 estudos realizados entre 2003 e 2014, avaliando o impacto da mutação nesse gene na ocorrência de abortos de repetição, 7 mostraram aumento do risco, enquanto 11 não mostraram qualquer impacto, sendo que os estudos que mostraram alguma impacto foram realizados com mulheres da Ásia e da África, enquanto que os estudos realizados com mulheres da Europa e da América do Norte não evidenciaram qualquer aumento de risco.
Por esse motivo tanto mutações no gene da MTHFR e do PAI-1 não foram consolidados como trombofilias hereditárias e não são reconhecidos como tal pelas principais sociedades de especialistas do mundo.
Quais as diferenças entre os vários tipos de anticoagulantes?
Primeiramente é importante definirmos o que são anticoagulantes. Esse termo geralmente é utilizado para os medicamentos que tem como mecanismo de ação interferir na cascata da coagulação do sangue. Vimos, no começo, que um trombo é formado principalmente por plaquetas e por uma substância que atua como “cola” do trombo, a fibrina. A produção de fibrina no nosso organismo ocorre através de uma série de passos chamados, em conjunto, de cascata da coagulação. Cada passo dessa cascata é feito por um fator da coagulação, num efeito dominó até que seja realizada a última etapa, a formação da fibrina.
São considerados anticoagulantes todos os medicamentos que interferem com a ação dessa cascata e, portanto, diminuem a formação de fibrina. A heparina, um anticoagulante injetável, por exemplo, atua se ligando e ampliando a função de um fator (antitrombina III) cuja ação principal é diminuir ou bloquear a última etapa necessária para a produção da fibrina. A redução da formação de fibrina diminui a chance de formação de novos trombos e o crescimento de trombos já formados. Muitas pessoas chamam essas consequências, de “afinar o sangue”. É importante salientar, porém, que os anticoagulantes diminuem a produção de fibrina, mas não destroem a fibrina que já foi formada. Por essa razão os anticoagulantes não eliminam os trombos, sendo esta a ação de medicamentos chamados trombolíticos, que podem ser, mas não são rotineiramente utilizados no tratamento de tromboses venosas.
Os anticoagulantes podem ser divididos, de maneira simples, naqueles que são injetáveis e naqueles que são ingeridos na forma de comprimidos. Os anticoagulantes injetáveis principais são a heparina e a enoxaparina. Ambos atuam através de sua ligação à antitrombina III, como destacado acima, mas possuem diferenças importantes, entre elas o fato de a enoxaparina não necessitar, na maioria das situações, de monitorização da dose (isto é, medir no sangue o efeito do medicamento e ajuster a dose de acordo), ao contrário da heparina. Elas são usadas, na maioria das vezes, como injeções subcutâneas, e o fato de a enoxaparina não necessitar de monitorização fez com que ela se tornasse mais utilizada. Esses anticoagulantes costumam ser utilizados no ambiente hospitalar, logo que se estabelece o diagnóstico de trombose venosa, enquanto a pessoa está internada.
Os anticoagulantes orais, por sua vez, se dividem em dois grupos: os dicumarínicos, entre os quais se destaca a varfarina, e os anticoagulantes orais diretos, comumente chamados de DOACs.
A varfarina é o anticoagulante oral mais antigo e por muito tempo foi um dos mais utilizados. Sua atuação se dá através da redução da produção de alguns fatores da coagulação. Esses fatores têm em comum o fato de dependerem da vitamina K para serem produzidos. Isso explica o impacto que a alimentação tem no uso dessa medicação: uma pessoa que come muita vitamina K vai precisar de doses maiores de varfarina, enquanto pessoas que comem pouca vitamina K tem uma ação mais potente deste medicamento.
Por esta razão a varfarina é um anticoagulante que requer a monitorização, ou seja, seu efeito deve ser medido no sangue e sua dose ajustada de acordo. Essa monitorização é feita através de um exame chamado de tempo de protrombina, que produz um parâmetro chamado RNI ou INR. Esse talvez seja um dos principais inconvenientes da medicação e a razão pela qual os DOACs tem ganhando popularidade e preferência na escolha do tratamento. Em algumas situações específicas, porém, a varfarina é o único anticoagulante oral considerado seguro. Síndrome do anticorpo antifosfolípide e presença de próteses metálicas de valvas cardíacas são as situações mais importantes onde a varfarina se mostrou superior aos DOACs, em termos de prevenção de trombose. Finalmente, apesar da maior complexidade para o ajuste de dose, a varfarina possui um antídoto, ou seja: em situações de superdosagem ou de sangramentos, o seu efeito pode ser agudamente revertido com o uso de vitamina K ou, no caso de sangramentos mais graves ou da necessidade de reversão imediata (como para procedimentos cirúrgicos, por exemplo) com a transfusão de um componente do sangue chamado de plasma fresco congelado.
Os DOACs (anticoagulantes orais diretos) tem esse nome em função do seu mecanismo de ação: diferente da varfarina, que diminui a produção de alguns fatores de coagulação, os DOACs se ligam diretamente a alguns fatores da coagulação, inibindo sua ação.
De maneira geral os DOACs apresentam menor risco de sangramento que a varfarina e não precisam de monitorização de dose (a pessoa toma doses fixas e não precisa colher exames para controlar o efeito do medicamento), sendo muito mais convenientes, desse ponto de vista. Por outro lado, como mencionado acima, eles não apresentam antídoto disponível no Brasil e não tem eficácia comparável à varfarina em algumas situações. Além disso, seu uso em pessoas portadoras de formas mais graves de insuficiência renal não é indicado .
Como pode-se ver, a escolha do anticoagulante mais adequada para cada pessoa depende de uma série de fatores, como a razão pela qual ela precisa tomar o anticoagulante, do seu risco de sangramento, da presença ou não de doenças que aumentam esse risco (p. ex., insuficiência renal), da disponibilidade da pessoa para monitorização do medicamento, entre outros.
Outra questão importante é com relação ao ácido acetilsalicílico (Aspirina ®). Este medicamento, que popularmente também é conhecido por suas ações no “afinamento” do sangue, não é um anticoagulante. A relação do ácido acetilsalicílico com a coagulação está na sua capacidade de bloquear a ligação entre as plaquetas (conhecido, por isso, como antiagregante plaquetário), mas sem interferir na cascata de coagulação e na produção de fibrina. A ligação direta entre plaquetas é mais importante na formação de trombos arteriais, por isso o ácido acetilsalicílico é muito utilizado nessas situações (prevenção de infartos, acidentes vasculares cerebrais). Sua ação na trombose venosa é mais limitada, restringindo-se principalmente a gestantes com síndrome do anticorpo antifosfolípide, em adição à enoxaparina, ou na prevenção de novos episódios de trombose em pessoas com um episódio prévio de trombose venosa sem fatores de risco associados (trombose não provocada).
Por quanto tempo uma pessoa que teve trombose venosa deve usar um anticoagulante?
A resposta para esta pergunta é multifatorial e vai variar de pessoa pra pessoa. Habitualmente, num primeiro episódio de trombose venosa, todas as pessoas devem fazer uso de anticoagulante por um período mínimo de 3 a 6 meses. Este período inicial é o da maior risco de um novo episódio de trombose, e por isso é mandatório para todos.
A continuidade da anticoagulação além desse período dependem de uma série de fatores relacionados diretamente ao risco de uma nova ocorrência. Tradicionalmente, pacientes com trombose provocada por fatores transitórios (por exemplo: cirurgias com anestesia geral, internações com imobilização prolongada, uso de contraceptivos orais, gestação) tem um risco muito baixo de recorrência passados esses 3-6 meses iniciais após a trombose e não necessitam de extensão da anticoagulação além desse período.
Por outro lado, pacientes com trombose provocada por fatores de risco não transitórios (pacientes com câncer, por exemplo) habitualmente tem a anticoagulação mantida enquanto persistir o fator de risco (por exemplo, enquanto o câncer estiver ativo).
Finalmente, pacientes com trombose não provocada (ou seja, trombose venosa não associada a fatores de risco) apresentam um risco de novo episódio de trombose mais elevado, passados os 3-6 meses iniciais. Esse risco é modulado por uma série de fatores, como idade, sexo, localização da trombose (mais próxima do quadril, denominada proximal ou embolia de pulmão vs. mais longe do quadril), persistência de trombo residual (ou seja, o organismo não consegue reabsorver todo o trombo, havendo persistência de um pedaço dele na circulação) e parâmetros laboratoriais como os dímeros-D (uma proteína resultante da degradação da fibrina e que, em termos gerais, reflete a ativação da cascata da coagulação). Nesses pacientes, o benefício da anticoagulação por períodos maiores na redução do risco de trombose deve ser contrabalanceado com o risco de sangramento associado ao uso de longo prazo dessas medicação. Por isso também são valorizados preferências e o estilo de vida do paciente: atividade física e de trabalho, preocupação com o risco de sangramento em oposição à preocupação com o risco de trombose, entre outros. A decisão deve ser individualizada, e o hematologista tem papel fundamental em determinar o que se enquadra mais no perfil de cada paciente.
Algumas situações de maior risco, porém, habitualmente impõem a necessidade do uso de anticoagulante sem prazo para interrupção. Tromboses recorrentes, sem fator que as justifique e principalmente na presença de trombofilias, síndrome do anticorpo antifosfolípide e determinadas malformações das veias e artérias que predispõe à trombose, apresentam risco muito elevado de um novo episódio de trombose, sugerindo fortemente a necessidade de manutenção do uso de medicamentos anticoagulantes por longos períodos.